下丘脑在人体生理功能中扮演着至关重要的角色,作为调节多种新陈代谢并控制自主神经系统的重要脑区,下丘脑直接影响人类的昼夜节律、食欲和血压等生理过程。同时,下丘脑还涉及认知和情感等高级功能,其参与精神分裂症、抑郁症和痴呆症等神经精神疾病的发病机理也受到广泛关注。尽管下丘脑对人类生理和健康有着举足轻重的作用,然而其遗传学研究仍十分缺乏。探索下丘脑的遗传结构能够加深我们对脑疾病内在机制的理解,对于促进脑健康研究具有重大的科学价值与临床意义。
近日,复旦大学计算神经科学与类脑智能教育部重点实验室冯建峰教授/程炜研究员团队联合复旦大学附属华山医院郁金泰/董强教授团队,携手国际多中心多学科交叉团队共同完成一项重要研究。研究团队基于覆盖不同年龄阶段的多队列数据,利用人工智能算法对超三万人被试的神经影像进行自动化精细分割,构建了迄今全球最大规模的下丘脑结构形态数据。该研究首次发现ADAMTS8基因在下丘脑结构形态中的关键作用,揭示了下丘脑结构的遗传基础,并报道了其与多种神经精神性状及疾病间紧密的遗传联系。这一成果为深入理解下丘脑功能及其在脑疾病中的作用机制,推动临床诊疗的进步,具有重要意义。

2024年1月5日,相关研究成果以《人类下丘脑的遗传结构及其与神经精神行为和疾病的关系》(“The genetic architecture of human hypothalamus and its involvement in neuropsychiatric behaviors and disorders”)为题发表于Nature子刊《自然·人类行为》(Nature Human Behaviour)。
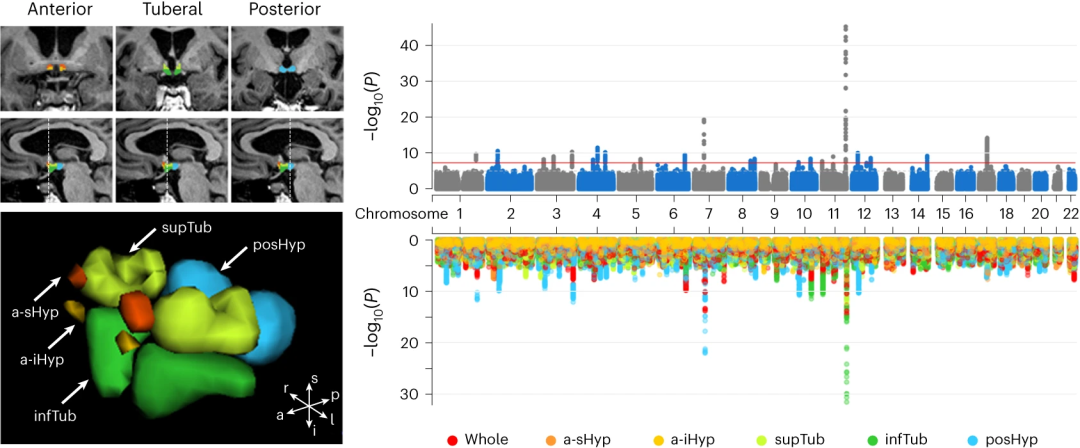
▲图1:基于人工智能算法的下丘脑影像自动分割与下丘脑全基因组关联分析的曼哈顿图
下丘脑结构复杂,亚区边界不清,针对这一难点问题,研究团队结合前期基于深度学习算法的神经影像建模经验,采用了聚焦微小脑区的3D卷积分割网络,通过对有限标注样本的迭代学习,实现了对下丘脑十个亚区的精准快速分割。借助该深度学习模型,团队对来自英国生物样本库(UK Biobank)中32,956人的颅脑核磁共振(MRI)图像进行自动标注,获得迄今为止最大规模的下丘脑结构形态数据。随后,利用这3.2万名参与者的遗传数据开展全基因组关联分析(GWAS),发现了23 个遗传位点和297个候选基因与下丘脑及其亚区结构显著关联。遗传度分析显示下丘脑结构具有低到中度水平的可遗传性(遗传度在10%至30%之间)。富集分析表明,这些基因与细胞内转运系统和类固醇相关化合物代谢过程密切相关,与既往对下丘脑功能的理解相一致。
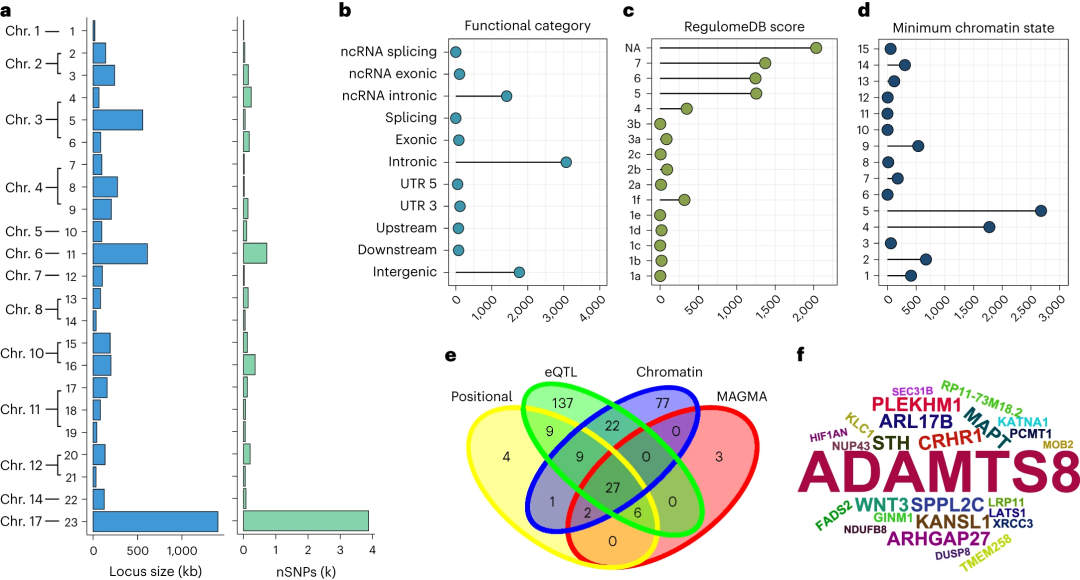
▲图2:与下丘脑显著关联的23个位点的功能注释和基因映射分析
“下丘脑结构十分精细。既往的下丘脑影像学分析主要是基于人工标注的分割方法,该方法耗时耗力,准确低,难以运用于大规模样本分析且复现性差。本研究采用基于人工智能的自动分割算法,在保证可靠性和精度的前提下极大的降低了人工成本,使得构建迄今最大的下丘脑结构形态数据库成为可能,并以此开展了首个下丘脑的大规模全基因组关联分析,是一个非常创新的工作。”本研究的共同通讯作者,实验室程炜研究员表示。
通过LDSC(连锁不平衡评分回归)和GCTA-GREML(全基因组复杂性状分析-基于基因组的限制性最大似然法)方法,研究团队发现了下丘脑与海马、海马旁回、基底前脑、伏隔、丘脑、苍白球、小脑、脑干、脑室等多个邻近结构存在显著的遗传相关性。同时,研究团队还分析了下丘脑和神经精神功能性性状的遗传关联,发现其与睡眠与节律、摄食、学习及认知、冒险行为、副交感神经/交感神经活动显著相关,具体指标包括了睡眠类型、睡眠时长、日间小睡、异常食欲、BMI(体重指数)、认知测试评分、首次性生活年龄、每日吸烟量、饮酒频率、血压、心率等。分析结果从结构和功能两方面为下丘脑和神经精神性状的关联提供了遗传学证据。
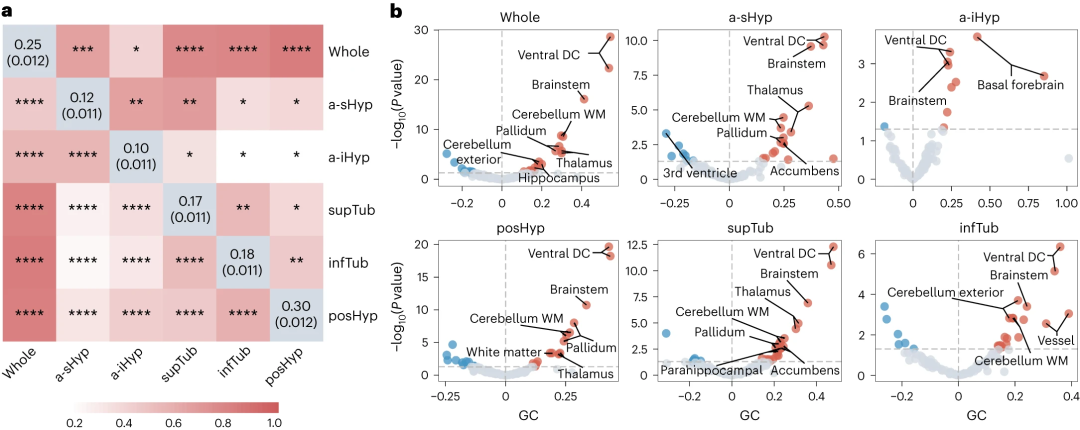
▲图3:下丘脑的遗传度及其与边缘系统结构之间紧密的遗传关联
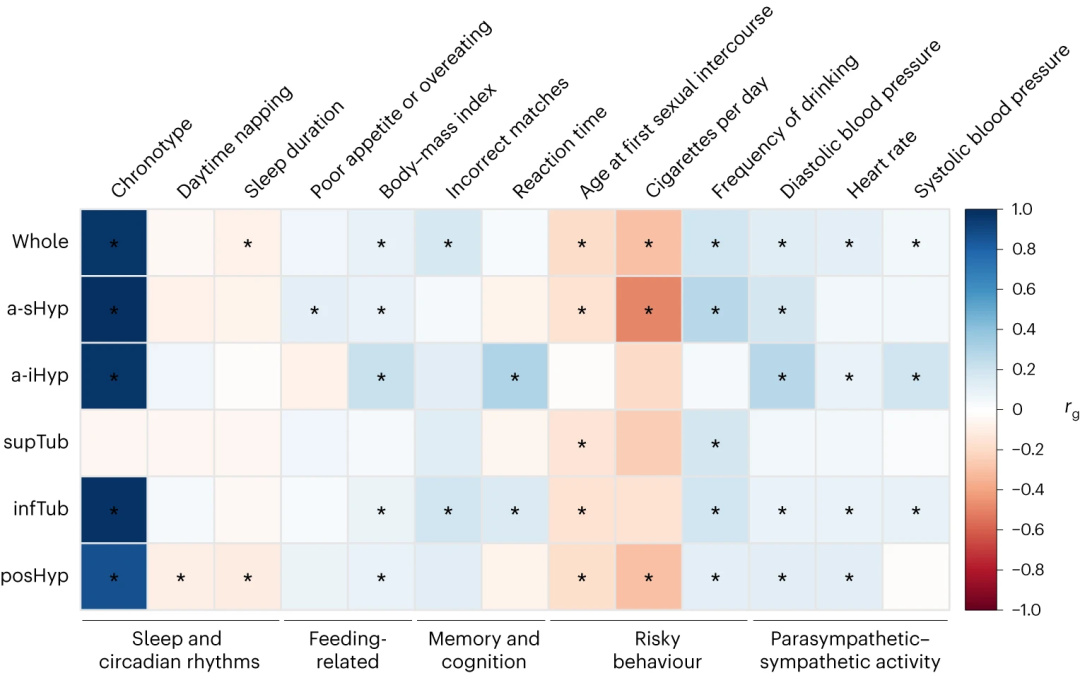
▲图4:下丘脑结构与多种神经精神功能性状的遗传关联
进一步,团队通过遗传多效性方法探索了下丘脑结构和神经精神疾病之间的遗传重叠,发现了其与精神分裂症、双相情感障碍、抑郁、创伤后应激障碍、卒中、帕金森等疾病存在不同程度的共有遗传位点。
实验室主任冯建峰教授表示:“对下丘脑空间结构的分析为了解其有关的生理和病理过程提供了独特的视角。本研究中下丘脑结构与多种昼夜节律表型呈现出一致的遗传关联性,这十分符合已有的关于下丘脑功能的生理学知识。此外,从脑结构到神经系统功能再到神经精神疾病,三个不同层次却高度一致的分析结果强有力地证实了下丘脑在神经精神疾病中发挥了重要作用。”
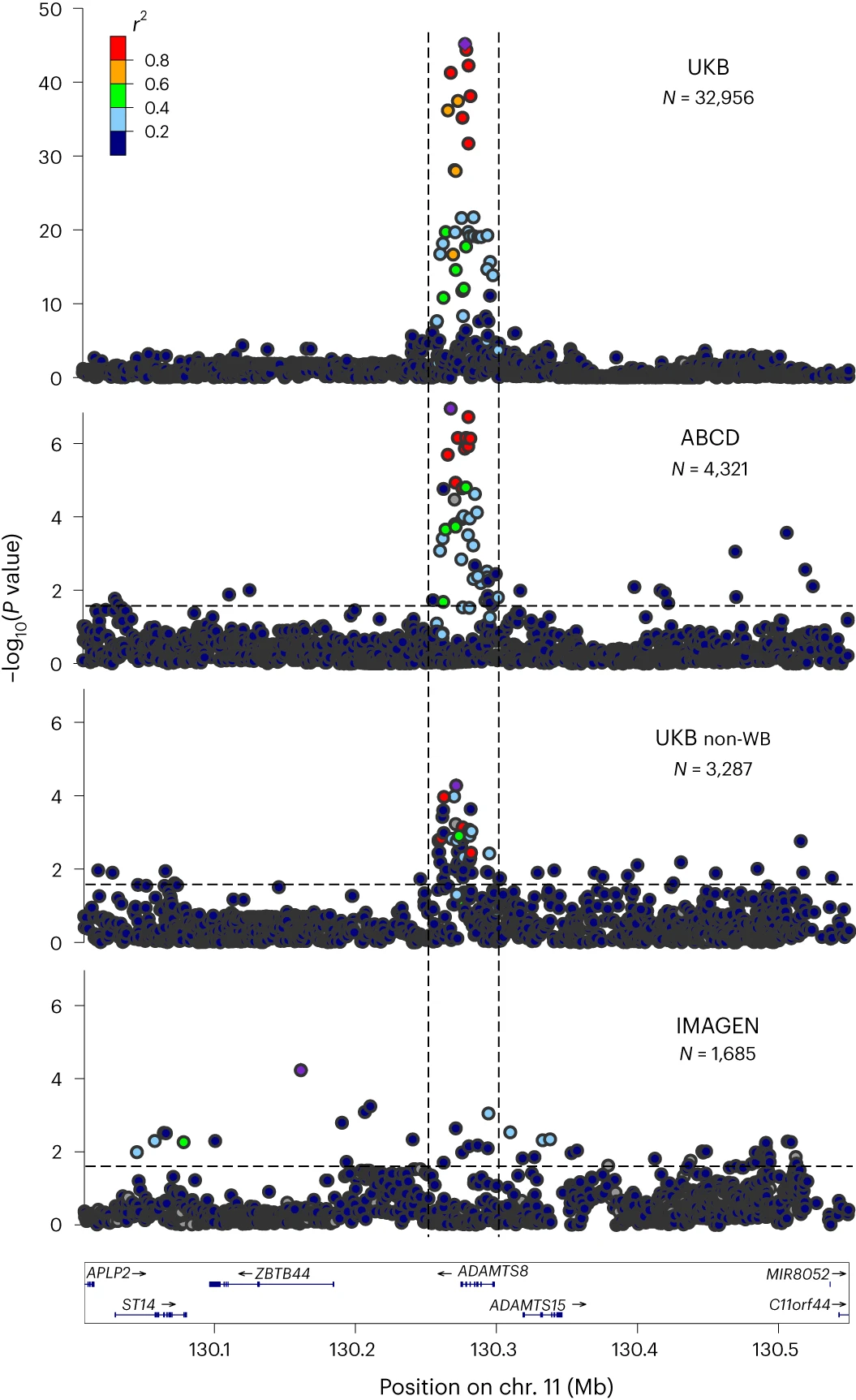
▲图5:ADAMTS8基因座在不同人群队列中的验证
通过UKB中非英国白人人群,ABCD队列人群及IMAGEN队列人群,团队验证了上述GWAS结果中信号最强的ADAMTS8位点。荟萃分析后,ADAMTS8位点上遗传变异与下丘脑间的关联显著性进一步增强。孟德尔随机化分析表明更低水平的ADAMTS8表达与更大体积的下丘脑之间有潜在的因果关联。
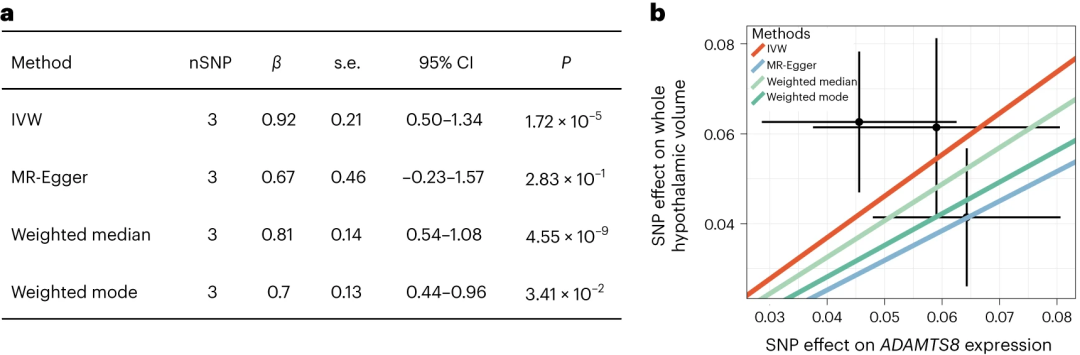
▲图6:ADAMTS8基因表达与下丘脑体积间的孟德尔随机化分析
本研究共同通讯作者,复旦大学附属华山医院郁金泰教授表示:“本研究首次发现ADAMTS8基因对下丘脑结构有着举足轻重的作用,且这一发现在不同队列数据和多种分析方法中均得以验证。
值得注意的是,在以青少年为主的ABCD和IMAGEN队列人群中同样观察到ADAMTS8与下丘脑结构之间的关联性,提示了ADAMTS8的作用或与年龄无关。这项发现为下丘脑形成的分子学机制提供了新的见解。”
复旦大学计算神经科学与类脑智能教育部重点实验室冯建峰教授、程炜研究员、复旦大学附属华山医院董强教授、郁金泰教授为论文共同通讯作者。复旦大学附属华山医院博士后陈仕东、博士生吴邦胜,实验室的博士后尤佳、博士生张威为共同第一作者。
该研究得到了英国生物样本库(UK Biobank)、美国“青少年大脑认知发展”(ABCD)项目、欧洲“正常大脑功能和精神病理学中的强化相关行为”(IMAGEN)项目、科技创新2030“脑科学与类脑研究”重大项目、国家自然科学基金、国家重点研发计划、上海市市级科技重大专项等经费支持。
原文链接:https://www.nature.com/articles/s41562-023-01792-6