睡眠对人类身体健康起着至关重要的作用,而慢性睡眠障碍大约影响全球30%的成年人。睡眠障碍与各种疾病和有害结局相关,包括心血管代谢性疾病、神经精神疾病、免疫功能障碍等,但其遗传调控机制及与疾病关系仍不明确。遗传关联研究成为研究睡眠的遗传结构并进一步探究分子机制的有力工具。与传统全基因组关联研究(GWAS)相比,全外显子关联分析主要研究蛋白编码突变,在发现人群中低频但对表型影响较大的罕见编码突变有着独特优势,为更全面揭示睡眠的遗传基础提供了新的契机。
近日,复旦大学计算神经科学与类脑智能教育部重点实验室程炜研究员团队与复旦大学附属华山医院郁金泰教授团队就睡眠表型的遗传基础这一重要科学问题展开联合攻关。基于近45万人的全外显子测序数据和关联分析算法,发现了与睡眠表型相关的新基因,进一步分析了罕见突变对睡眠表型的遗传贡献,并解释了睡眠与认知、神经精神疾病和炎症等健康结局关联的遗传机制。该研究发现不仅丰富了我们对睡眠遗传机制的理解,也为开发新的睡眠障碍治疗方法提供了新的潜在生物学标记。

当地时间2024年1月4日,相关研究成果以《外显子测序发现与睡眠相关表型关联的基因》(Exome sequencing identifies genes associated with sleep-related traits)为题发表于Nature子刊《Nature Human Behaviour》。
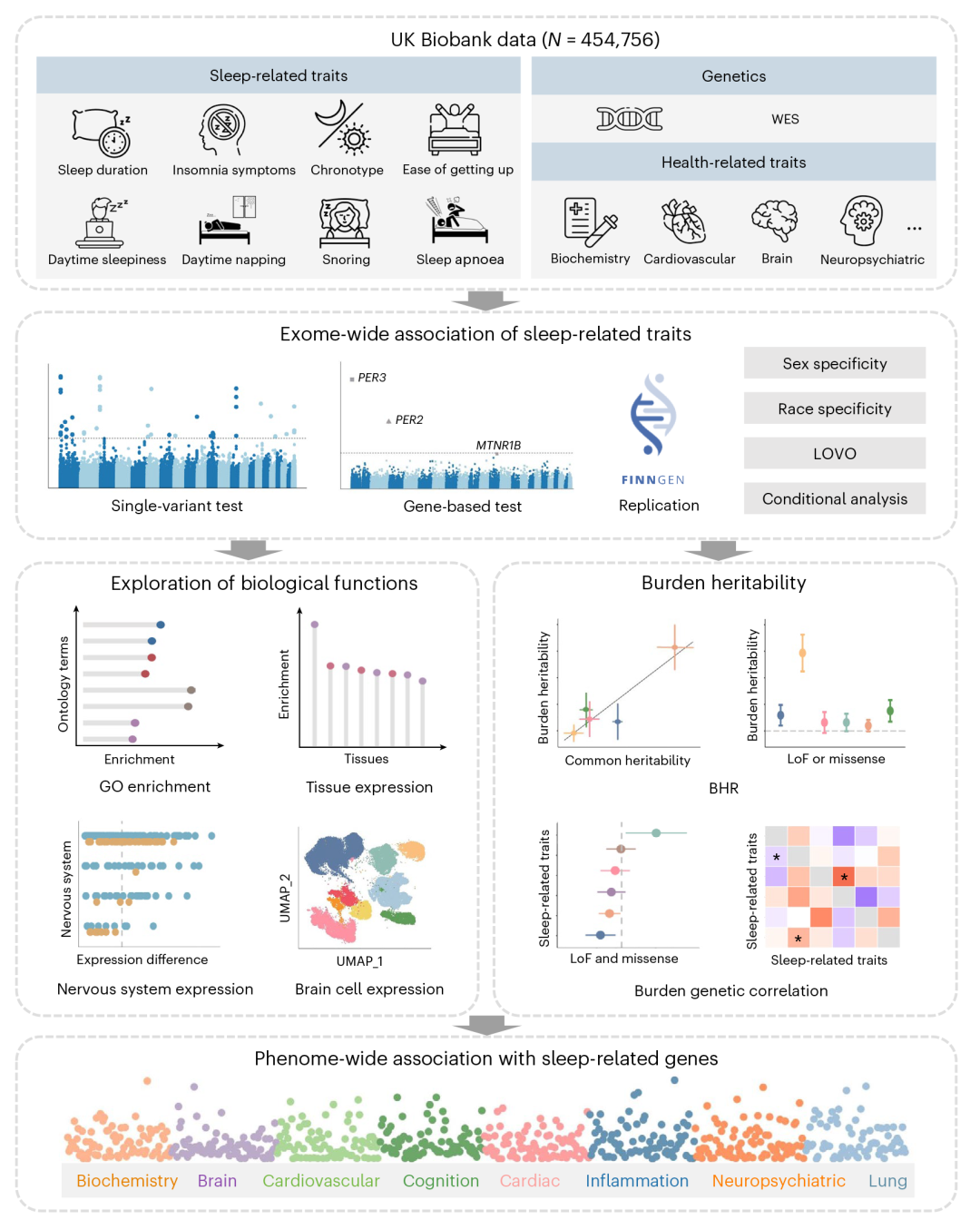
▲图1:课题研究思路
研究团队基于英国生物样本库(UK Biobank)近45万人的全外显子测序数据和睡眠表型数据,对睡眠持续时间、失眠症状、睡眠时间类型、白天嗜睡、白天打盹、早上起床是否容易、打鼾和睡眠呼吸暂停等八种常见睡眠表型进行了全外显子关联分析(Exome-Wide Association Study, ExWAS),共发现了68个与睡眠表型相关的基因,其中22个为新发现的基因。进一步在芬兰FinnGen数据库中进行了验证,并通过多种敏感性分析证实了其稳定性。
此外,研究还发现这些基因在与昼夜节律相关的通路中富集,且主要在中枢神经系统的神经元中表达。最后研究团队进一步探究了这些基因与生化、脑结构、心血管疾病、认知、心功能、炎症、神经精神疾病、肺功能等指标和疾病的关联。
实验室共同通讯作者程炜研究员表示:“我们的研究是迄今为止样本量最大、纳入表型全面的睡眠的全外显子关联分析。这一研究补充了既往睡眠GWAS研究的不足,罕见突变进一步解释了睡眠的部分遗传度,并发现了影响睡眠的新基因,这些基因同时对认知功能、神经精神疾病、炎症等方面存在影响。这些结果有助于提高我们对相关生物学过程分子机制层面的理解,同时也有望应用于睡眠障碍诊疗的精准医学。”
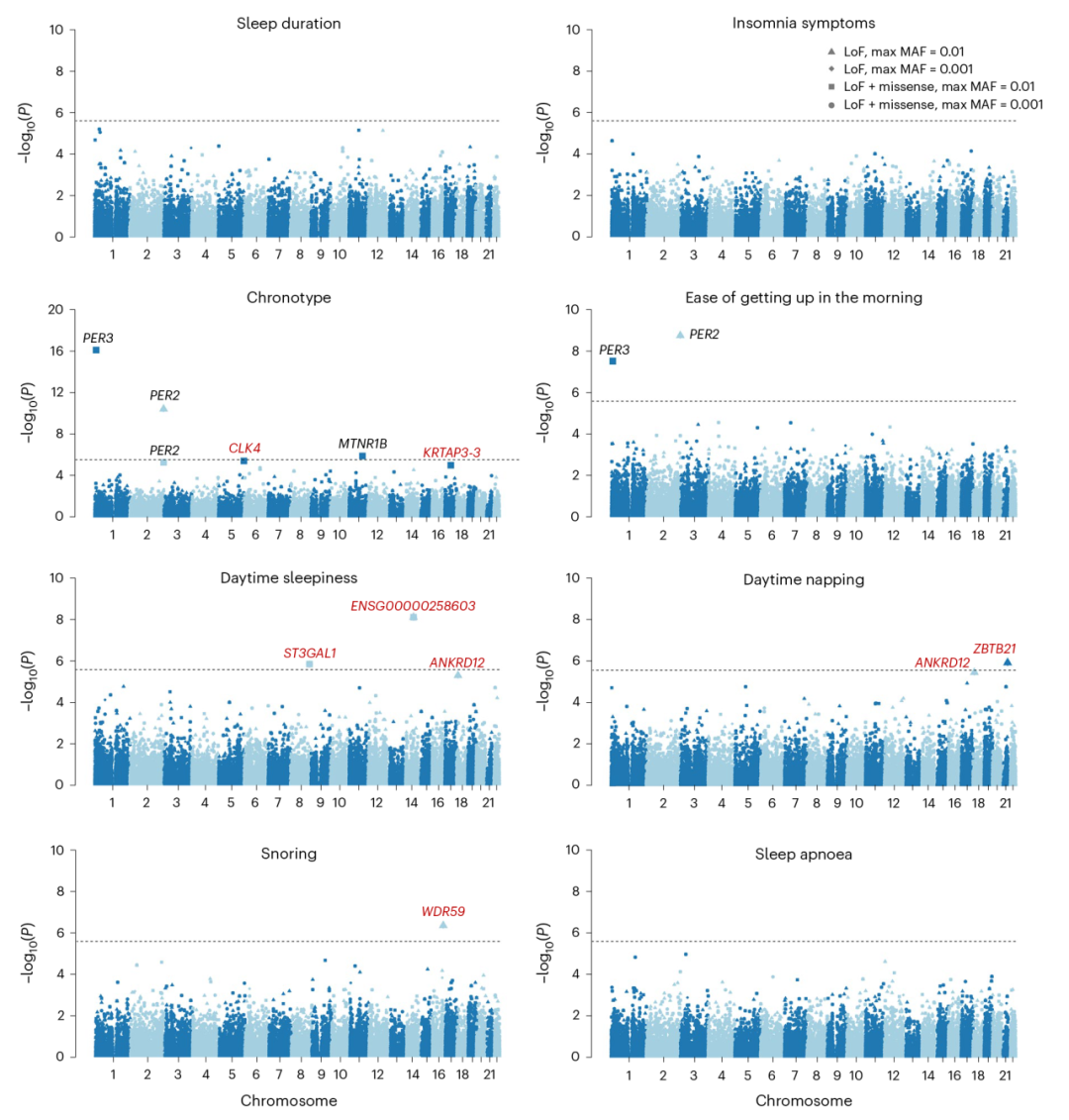
▲图2:罕见突变与八种睡眠表型的关联
研究团队首先通过单变异(single-variant)和基于基因(gene-based)两个水平对基因变异与睡眠表型进行关联分析,共发现了68个基因至少与一个睡眠表型显著关联,其中22个基因为该研究首次报道,这22个基因中的20个在FinnGen数据库中得到了验证。随后,对人群进行分性别、分种族的敏感性分析证实了这些基因的稳定性。留一分析(leave-one-variant-out analysis)说明关联由位于一个基因内的罕见突变的整体负担而非某个单个突变驱动。条件分析(conditional analysis)说明罕见变异对表型的影响独立于附近的常见位点。
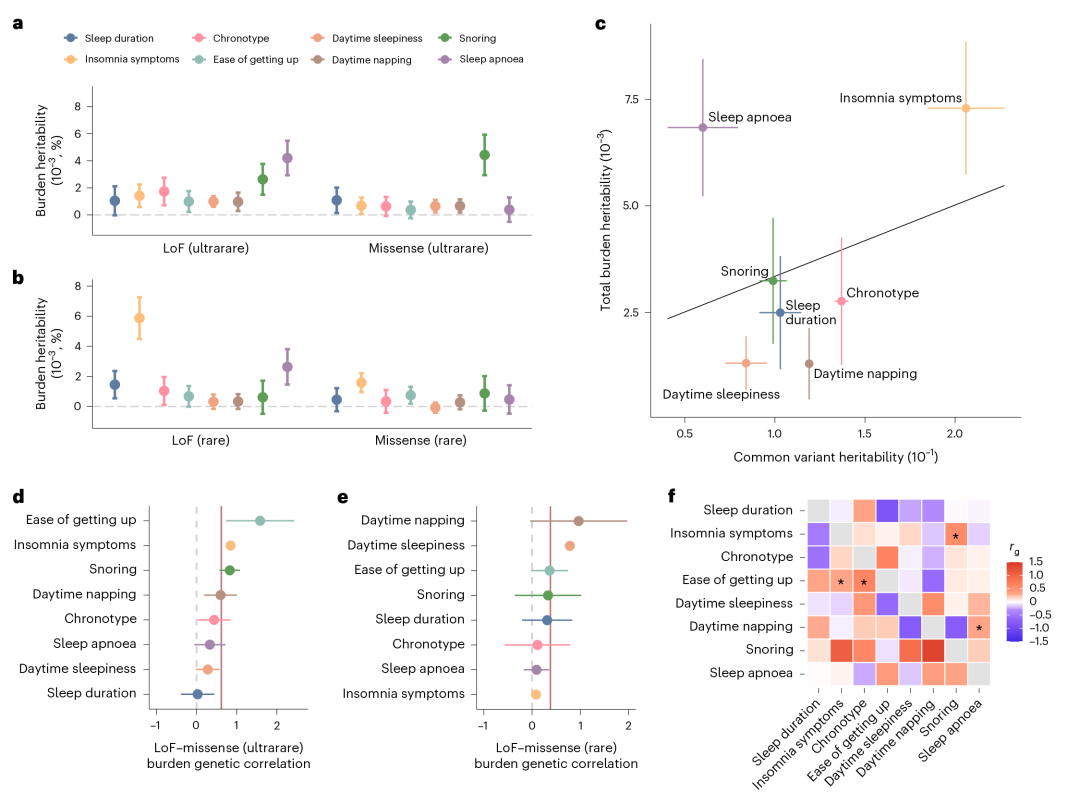
▲图3:睡眠表型的负担遗传度及遗传相关性
进一步,通过负担遗传度回归(burden heritability regression,BHR)方法,研究团队探索了不同类型的罕见突变对睡眠表型遗传度贡献,结果显示失眠症状有着较高的负担遗传度,且负担遗传度与既往报道的常见变异遗传度正相关。遗传关联分析则提示睡眠时间类型与早上起床是否容易、打鼾与失眠症状等表型间有着显著遗传关联。
“本研究使用了自我报告的睡眠表型,表型的覆盖范围广、样本量大,能有效提高关联研究的统计效能,并通过BHR等全新的研究技术,进一步刻画了睡眠的遗传结构。此外,睡眠与认知、神经精神疾病的关联一直是研究热点,本研究从遗传学角度为解释其机制提供了证据。”该研究项目的共同通讯作者,复旦大学附属华山医院郁金泰教授表示。

▲图4:睡眠相关基因的富集与组织表达分析
随后研究团队探究了所发现基因的生物学功能。通过GO富集分析,这些基因富集于昼夜节律和调控昼夜节律的通路。其基因表达量则通过差异表达分析富集于胰腺、海马、肾上腺等组织。利用小鼠和人脑的单细胞测序数据,研究发现了这些基因在不同解剖部位和不同细胞类型中的表达模式,部分基因在中枢神经系统神经元中高表达。
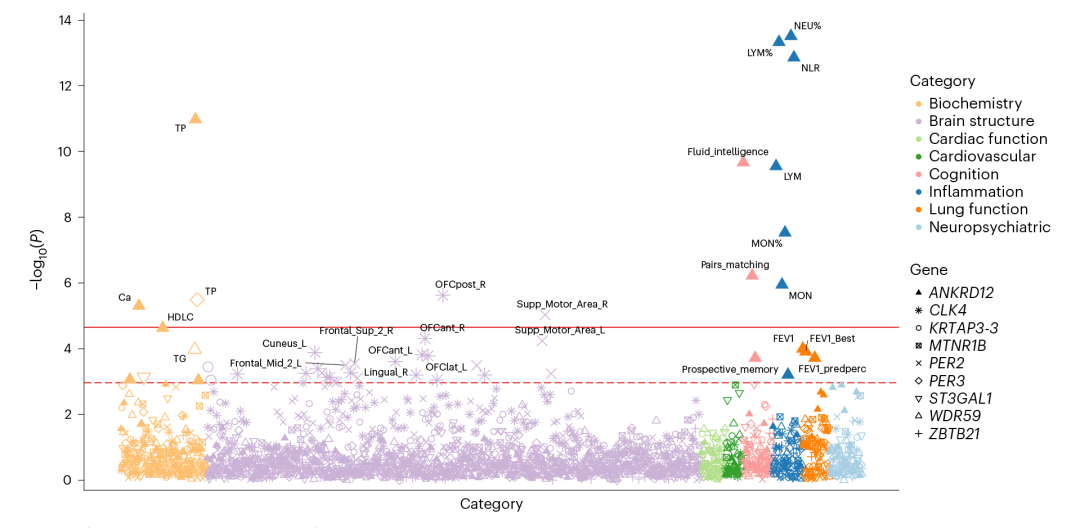
▲图5:睡眠相关基因与认知功能、炎症指标相关联
最后,为研究睡眠相关基因对其他表型的影响并解释睡眠和其他表型关联的潜在机制,研究团队对发现的基因进行了全表型组关联分析(PheWAS),共纳入了包括生化、脑结构、心血管疾病、认知、心功能、炎症、神经精神疾病、肺功能等指标和疾病在内的8类共249个表型。PheWAS发现ANKRD12基因与认知功能、炎症指标、生化指标等多类表型有着关联。
实验室主任冯建峰教授表示:“睡眠影响着人类健康的方方面面,通过大规模外显子测序数据发现与睡眠相关的基因,一方面补充了睡眠的GWAS研究未覆盖到的罕见突变的空白,另一方面也说明了临床大队列对于临床诊疗、疾病机制研究的重要作用。未来我们将基于遗传、分子、影像与临床等跨尺度大数据,继续对睡眠问题展开系统的研究,并期待这些成果能够落地,让老百姓能够睡得好!”
睡眠表型有着中等程度的遗传度,遗传学研究是探究调控睡眠的分子通路、解释睡眠影响健康机制的重要工具,既往研究主要为全基因组关联分析(GWAS),聚焦于常见突变对睡眠表型的作用。而这项研究是迄今为止睡眠表型的最大规模的全外显子关联研究,衡量了罕见突变对睡眠相关表型的影响,证明了分析大规模全外显子数据对理解睡眠的遗传结构具有重要作用。
该工作是冯建峰、程炜与郁金泰联合研究团队继揭示中老年睡眠最佳时长神经机制之后在睡眠研究领域又一新突破。在2018年团队发现成人睡眠与抑郁共病的脑连接基础1,随后在儿童睡眠研究中发现儿童睡眠紊乱及多动症之间的共病关系及关键共病脑区2,并发现儿童睡眠时长与多维度行为表征的作用关系及背后的神经影像机制3。2022年,团队进一步研究发现中老年人睡眠时长与精神健康关系及其遗传神经机制4,并揭示了睡眠、身体活动与痴呆发病风险的关系5,系列工作发表于精神疾病领域顶级期刊JAMA Psychiatry、Nature Aging及Molecular Psychiatry等。
复旦大学计算神经科学与类脑智能教育部重点实验室程炜研究员、复旦大学附属华山医院神经内科郁金泰教授为该文的共同通讯作者,实验室硕士研究生李泽雨以及复旦大学附属华山医院神经内科八年制博士生费晨杰、宁静、杨柳为该文的共同第一作者。
该研究得到了复旦大学计算神经科学与类脑智能教育部重点实验室冯建峰教授、复旦大学基础医学院药理学系黄志力教授、复旦大学附属华山医院神经内科睡眠障碍诊治中心于欢教授等的大力支持和帮助。该研究得到了科技创新2030-“脑科学与类脑研究”重大项目、国家自然科学基金委、国家重点研发计划、上海市市级科技重大专项等的经费支持。
原文链接:https://www.nature.com/articles/s41562-023-01785-5
引用论文:
1. Cheng, W., Rolls, E. T., Ruan, H. T. & Feng, J. F. Functional Connectivities in the Brain That Mediate the Association Between Depressive Problems and Sleep Quality. Jama Psychiatry 75, 1052-1061 (2018).
2. Shen, C. et al. What Is the Link Between Attention-Deficit/ Hyperactivity Disorder and Sleep Disturbance? A Multimodal Examination of Longitudinal Relationships and Brain Structure Using Large-Scale Population-Based Cohorts. Biol Psychiatry 88, 459-469 (2020).
3. Cheng, W. et al. Sleep duration, brain structure, and psychiatric and cognitive problems in children. Mol Psychiatry 26, 3992-4003 (2020).
4. Li, Y. et al. The brain structure and genetic mechanisms underlying the nonlinear association between sleep duration, cognition and mental health. Nat Aging 2, 425-437 (2022).
5. Huang, S. Y. et al. Sleep, physical activity, sedentary behavior, and risk of incident dementia: a prospective cohort study of 431,924 UK Biobank participants. Mol Psychiatry 27, 4343-4354(2022).